ギブズ-ヘルムホルツ式
例として 1atmの下でのアンモニア生成について、これらの温度依存性を求めてみる。 しかし、ここでは、これらの量はすべて電池反応の進行にともなう自由エネルギーの 変化分(<0)とすることにする。
1例として 1atmの下でのアンモニア生成について、これらの温度依存性を求めてみる。 しかし、ここでは、これらの量はすべて電池反応の進行にともなう自由エネルギーの 変化分(<0)とすることにする。
1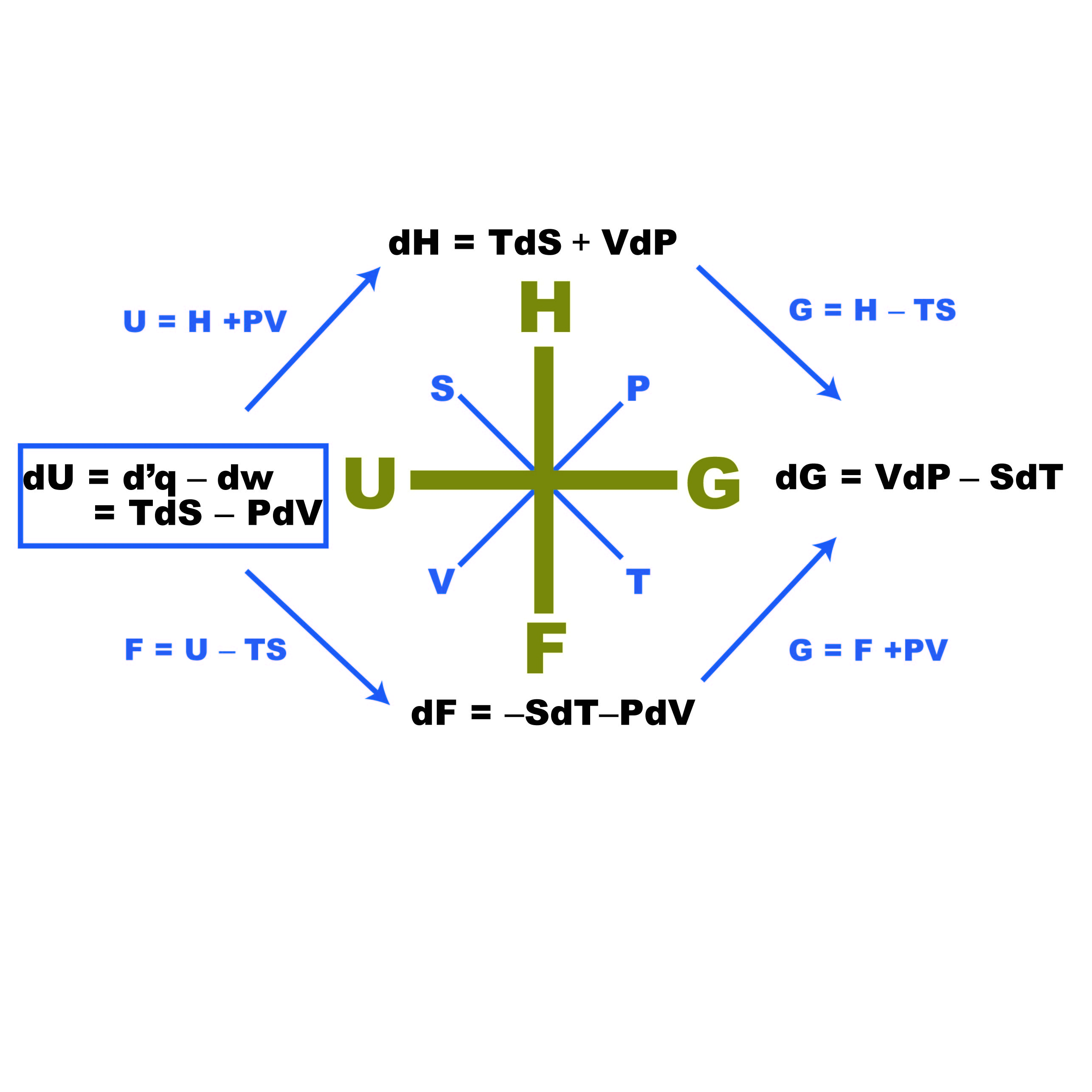
反応物、生成物が標準状態(1atm,298K)で持つギブズの自由エネルギー値は、別稿で説明したようにして反応熱や比熱のデータから求めることができる。 その具体的な方法は別稿をご覧下さい。 以下、ヘルムホルツエネルギーを例にとって説明する。

このとき、内部エネルギーの変化分はまさに 定温・定積下に於ける反応熱(相転移熱)です。 一つ目の式は、体積一定のもとエントロピーと内部エネルギーの比が絶対温度になることを意味し、二つ目の式は、一定エントロピーのもと、体積と内部エネルギーの比は、圧力の符号を逆にしたものに等しいということを意味します。 .熱容量(比熱) 別稿およびで説明したように、定積熱容量と定圧熱容量は と表される。
9荷電粒子の運動や反応に対する駆動力は電気化学ポテンシャルの勾配できまる。 [重要な注意] ただし、ここで としている。 図から解るようにT 1よりも遙かに低い温度T 2に達する。
7