第101章 実験-凝固点

ここでは、沸点上昇と凝固点降下の計算で注意しておきたいことをまず言っておきます。 溶液の濃度が濃ければ濃いほど沸点は上昇し、凝固点は降下する。
12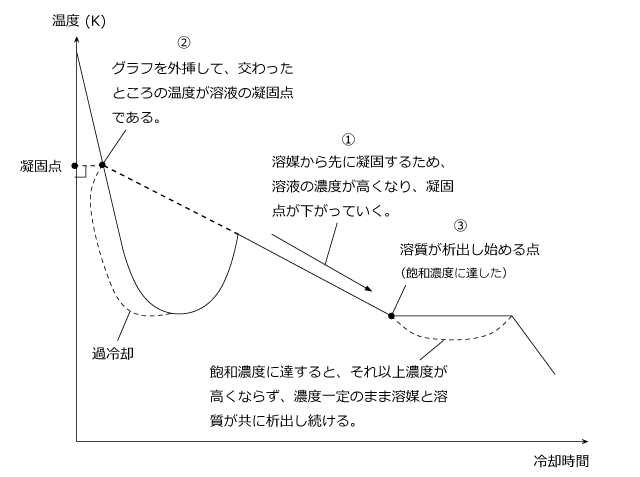
半透膜を通って浸透してくる溶媒粒子を阻止するために、溶液側から加える圧力の最小値を「浸透圧 osmotic pressure 」といいます。
8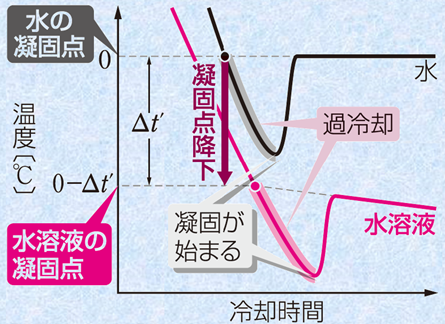
これが融点ですが、融点では融解熱と加熱が釣り合うため温度が動きません。 このグラフの左右を入れ替える。 公式に出てくる mは 質量モル濃度といって、溶媒粒子の質量(kg)に対する溶質粒子の個数を表したものになっています。
11
数学的な記述 [ ] 希薄溶液における点降下は的には次の式に従う。 って感じになるんですけど、なぜこういう単位になるのか 単位からどう定義を連想させるのか がよくわかりません。 文章にするとこんな感じなのですが、表にすると下のようになります。
この状態のことを 過冷却という。 このように溶液の凝固点が純溶媒より凝固点が下がることを凝固点降下といい、その差を凝固点降下度といいます。 しかしながら、溶液中の溶媒粒子は自由に通すけれども、溶質粒子は通さないという性質を持つ「半透膜 semipermeable 」で、溶液と純溶媒を仕切っておくと、溶媒粒子が半透膜を通って、溶液の方へ移動していきます。
4
1 B 2 100. 過冷却と寒剤について 過冷却…高温側から冷却したとき,転移温度を過ぎても転移現象がみられない現象をいう。 寒剤…氷が一部融けて水になり,塩化ナトリウムがその中に溶解すると,氷の融解熱と塩化ナトリウムの溶解熱によって温度は徐々に降下するが,共融点に達すると融解は止まり,温度は一定に保たれる。
10