亜酸化窒素
5重結合を形成します。

5重結合を形成します。

そのため、製造時にはといった湿度管理(水分管理)ができる場所で電池を組み立てる必要があります。 窒素の重さを求めてみよう【1立方メートル(m3:立米)あたりの質量】 このように、窒素の化学式や密度や質量の求め方が理解できましたら、続いて窒素の質量を練習問題を交えて計算していきましょう。 2008年時点での温室ガスとしての影響は、二酸化炭素の0. よって一酸化炭素(CO)の構造式は以下のようになるのです。

1個ずつ出しあうと単結合。 すると、どちらの原子にとっても8個ずつ持っている状態に見えますので、安定的に存在することができます。 窒素分子はなぜ三重結合をつくるのか? 歴史 [ ] 窒素は、かつて物が燃える元と考えられていたの研究の過程で発見されたもので、最初に単体分離を行った者の特定は困難である。
すると重なった部分(2つの原子間)の電子密度が高くなり、この軌道の電子は2. 大学で習うのですがこの反応は求核置換反応でアニリンNHのNにある非共有電子対が無水酢酸のカルボニル基のCを攻撃し、電子移動で無水酢酸の一部分が酢酸イオンとして脱落する事で進行します。 まず、簡単に水素原子2つから水素分子1つができる過程を考えます。
14
分子を構成する原子の数を表しただけのものが分子式です。 は、を「火の空気」、窒素を「駄目な空気」と命名した。 これは炭素Cの最外殻電子が4個、酸素Oの最外殻電子が6個であることからこのようになるのがわかるでしょう。
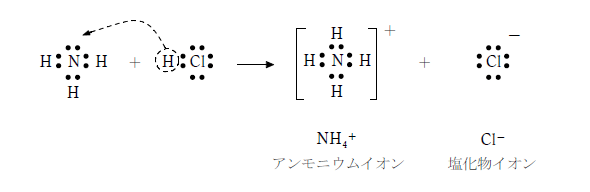
窒素原子:電子7個(価電子5つ)• ルイス構造(ルイスこうぞう、: Lewis structure)は、の周りにを無視してのみを点( ・)で表したの一種で、中に存在する間の結合とを示す図である。 書き方は難しくないですが、必ず内容を理解しなければいけません。 また窒素原子は価電子が5つです。
7
左端から1s、2s(二分割し内部構造を露出させている)、2p x、2p y、2p z 軌道である。 つまり、結合ができている場合には、その2個の原子が結合に使われている電子を同数ずつ分け合うと考えるわけです。 貴ガス(希ガス)と同じ電子配置を取ることで安定となる それでは、なぜオクテット則では最外殻電子が8個になるように電子を描くのでしょうか。
18関連記事. そのために、アルキル基の数が多いほどカルボカチオンが安定であり、それを言い換えると「カルボカチオンの安定性は、第三級>第二級>第一級である」ということになるわけです。 その結果、最外殻電子を8個(水素の場合は2個)にしようとするのです。